
Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Az új megközelítés blokkolja a rákos sejtek adaptációját és megduplázza a kemoterápia hatékonyságát
Utolsó ellenőrzés: 27.07.2025
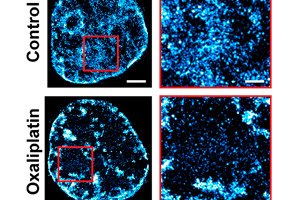
A Northwestern Egyetem biomedicinális mérnökei egy teljesen új megközelítésben a rákkezelésben megduplázták a kemoterápia hatékonyságát egy állatkísérletben.
Ahelyett, hogy közvetlenül a rákot támadná, ez az egyedülálló stratégia megakadályozza, hogy a rákos sejtek rezisztenssé váljanak a kezelésekkel szemben – így a betegség fogékonyabbá válik a meglévő gyógyszerekkel szemben. Ez a megközelítés nemcsak gyakorlatilag kiirtotta a betegséget a sejtkultúrákban, hanem jelentősen javította a kemoterápia hatékonyságát a petefészekrák egérmodelljeiben.
A tanulmány a Proceedings of the National Academy of Sciences folyóiratban jelent meg.
„A rákos sejtek nagyszerű alkalmazkodók” – mondja Vadim Backman, a Northwestern Egyetem munkatársa, a tanulmány vezetője. „Szinte bármihez képesek alkalmazkodni. Először megtanulják, hogyan kerüljék el az immunrendszert. Aztán megtanulják, hogyan álljanak ellen a kemoterápiának, az immunterápiának és a sugárterápiának. Amikor rezisztenssé válnak ezekre a kezelésekre, tovább élnek, és új mutációkat szereznek. Nem akartuk közvetlenül elpusztítani a rákos sejteket. El akartuk venni tőlük a szuperképességüket – a veleszületett képességüket az alkalmazkodásra, a változásra és az elkerülésre.”
Backman a Sachs család biomedicinális mérnöki és orvostudományi professzora a Northwestern Egyetem McCormick Műszaki Karán, ahol a Fizikai Genomikai és Mérnöki Központot vezeti. Emellett tagja a Robert H. Leury Átfogó Rákkutató Központnak, az Életfolyamatok Kémiai Intézetének és a Nemzetközi Nanotudományi Intézetnek.
A kromatin a kulcs a rák túléléséhez
A ráknak számos jellegzetes vonása van, de mindegyik mögött egy vonás áll: a túlélés kérlelhetetlen képessége. Még akkor is, ha az immunrendszer és az agresszív orvosi kezelések megtámadják a daganatot, a rák összezsugorodhat vagy lelassulhat a növekedése, de ritkán tűnik el teljesen. Bár a genetikai mutációk hozzájárulnak a rezisztenciához, a mutációk túl lassan mennek végbe ahhoz, hogy megmagyarázzák a rákos sejtek gyors stresszreakcióját.
Backman csapata egy sor tanulmányban feltárt egy alapvető mechanizmust, amely megmagyarázza ezt a képességet. A kromatinnak nevezett genetikai anyag komplex szerveződése határozza meg a rák alkalmazkodóképességét és túlélési képességét még a legerősebb gyógyszerek hatására is.
A kromatin, egy DNS-t, RNS-t és fehérjéket magában foglaló makromolekulákból álló csoport, meghatározza, hogy mely gének represszálódnak és melyek fejeződnek ki. Ahhoz, hogy a genomot alkotó két méternyi DNS-t a sejtmagban mindössze egy századmilliméternyi helyre lehessen sűríteni, a kromatin rendkívül tömör.
A képalkotás, a modellezés, a rendszerelemzés és az in vivo kísérletek kombinálásával Backman csapata megállapította, hogy a csomag 3D-s architektúrája nemcsak azt szabályozza, hogy mely gének aktiválódnak, és hogyan reagálnak a sejtek a stresszre, hanem lehetővé teszi a sejtek számára, hogy fizikailag kódolják a géntranszkripciós minták „memóriáját” magának a csomagnak a geometriájába.
A genom háromdimenziós elrendeződése egy öntanuló rendszerként működik, hasonlóan egy gépi tanulási algoritmushoz. Ahogy a genom „tanul”, ez az elrendeződése folyamatosan átszerveződik több ezer nanoszkopikus kromatin csomagoló doménné. Minden domén a sejt transzkripciós memóriájának egy darabját tárolja, amely meghatározza a sejt működését.
A kromatin újraprogramozása a kemoterápia fokozása érdekében
Az új tanulmányban Backman és kollégái egy olyan számítási modellt fejlesztettek ki, amely fizikai elveket alkalmaz annak elemzésére, hogy a kromatin csomagolása hogyan befolyásolja a rákos sejtek kemoterápiás túlélési valószínűségét. A modell különböző típusú rákos sejtekre és kemoterápiás gyógyszerosztályokra való alkalmazásával a csapat megállapította, hogy pontosan meg tudja jósolni a sejtek túlélését – még a kezelés megkezdése előtt.
Mivel a kromatin csomagolása kritikus fontosságú a rákos sejtek túlélése szempontjából, a tudósok feltették maguknak a kérdést: mi történne, ha a csomagolás architektúrája megváltozna? Új gyógyszerek létrehozása helyett több száz meglévő gyógyszert vizsgáltak át, hogy olyan jelölteket találjanak, amelyek módosíthatják a sejtmagokon belüli fizikai környezetet és befolyásolhatják a kromatin csomagolását.
Végül a csapat a celekoxibot választotta, egy FDA által jóváhagyott gyulladáscsökkentő gyógyszert, amelyet már használnak ízületi gyulladás és szív- és érrendszeri betegségek kezelésére, és amely mellékhatásként megváltoztatja a kromatin csomagolását.
Kísérleti eredmények
A celekoxib és a standard kemoterápia kombinálásával a kutatók jelentős növekedést tapasztaltak az elpusztult rákos sejtek számában.
A petefészekrák egérmodelljeiben a paklitaxel (egy gyakori kemoterápiás gyógyszer) és a celekoxib kombinációja csökkentette a ráksejtek adaptációjának sebességét és javította a tumornövekedés elnyomását, felülmúlva a paklitaxel önmagában nyújtott hatását.
„Amikor alacsony dózisú kemoterápiát alkalmaztunk, a daganatok tovább nőttek. De miután hozzáadtunk egy TPR-t (transzkripciós plaszticitásszabályozót) a kemoterápiához, sokkal jelentősebb növekedésgátlást tapasztaltunk. Megduplázta a hatékonyságot” – mondta Backman.
Lehetséges kilátások
Ez a stratégia lehetővé teheti az orvosok számára, hogy alacsonyabb kemoterápiás dózisokat alkalmazzanak, csökkentve a súlyos mellékhatásokat. Ez jelentősen javítaná a betegek komfortérzetét és a rákkezeléssel kapcsolatos tapasztalataikat.
Backman úgy véli, hogy a kromatin átprogramozása kulcsfontosságú lehet más összetett betegségek, köztük a szív- és érrendszeri, valamint a neurodegeneratív betegségek kezelésében.
