
Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A mesterséges intelligencia a patológusok által figyelmen kívül hagyott korai stádiumú prosztatarákot is kimutatja
Utolsó ellenőrzés: 23.08.2025
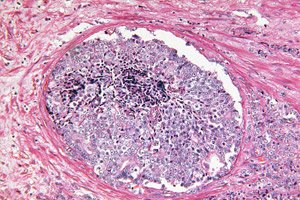 ">
">Egy tudományos jelentések szerint a mesterséges intelligencia képes felismerni a prosztata biopsziákban található rejtett morfológiai daganatnyomokat, amelyeket korábban a patológus jóindulatúnak ítélt. Egy gyengén felügyelt megközelítéssel betanított mélytanulási modell megjósolta, hogy a következő 30 hónapban mely, emelkedett PSA-szinttel rendelkező férfiaknál alakul ki klinikailag jelentős prosztatarák (ISUP > 1), és melyek maradnak legalább 8 évig rákmentesek. Ez megnyitja az utat a korai kockázatbecslés előtt közvetlenül egy kezdeti „tiszta” biopszia után, és segíthet eldönteni, hogy kinek van valóban szüksége ismételt invazív beavatkozásokra és fokozott megfigyelésre.
A tanulmány háttere
A prosztata primer tűbiopsziája gyakran álnegatív eredményt ad: a klinikailag jelentős rákos megbetegedések jelentős része „szűrésen kívül” marad, különösen a hagyományos szisztematikus TRUS biopszia esetén. Az MRI-vezérlés bevezetése növelte a klinikailag jelentős rákkimutatások arányát, és csökkentette a szükségtelen ismételt beavatkozások számát, de még a modern stratégiák mellett is egyes agresszív daganatok észrevétlenek maradnak. A klinikai dilemma továbbra is ugyanaz: kit kell megfigyelni egy „tiszta” biopszia után, és kit kell korai ismételt biopsziára utalni, hogy ne késleltessük a diagnózist, és ne terheljük túl a betegeket invazív beavatkozásokkal.
A probléma megoldásának biológiai alapja a TINT (tumor-instructed/indicating normal tissue, azaz tumor-instructed/indicating normal tissue) jelenség: a tumor „átalakítja” a szerv látszólag normális szöveteit, gyenge, de szisztematikus nyomokat hagyva bennük – a stromális átalakulástól és hipoxiától kezdve az anyagcsere-eltolódásokig. Ezeket a változásokat kísérleti modellekben és prosztatarákos betegeknél írták le, és korrelálnak a tumor agresszivitásával, ami a „normál” szövetet a diagnosztikai jelek potenciális forrásává teszi, még akkor is, ha a biopsziás mintában nincsenek nyilvánvaló rákos mirigyek.
A digitális patológia és a mélytanulási módszerek célja az ilyen „finom” terepi jellemzők kinyerése a standard H&E metszetekből. A klasszikus morfológiával ellentétben, amely a nyilvánvaló tumorstruktúrákra összpontosít, az algoritmusok képesek rögzíteni a sztrómában és az epiteliális hámban található elosztott mintázatokat, amelyek a szerv egy másik részében lévő tumor jelenlétéhez kapcsolódnak. Ez megnyitja az utat a kockázati rétegződés előtt közvetlenül negatív biopszia után: a magas üveg „pontszám” a korai ismételt biopszia vagy MRI-vezérlés célszerűségét sugallja, az alacsony pedig a kíméletesebb megfigyelést támogatja.
Ez az elképzelés áll a Scientific Reportsban megjelent új tanulmány mögött: a szerzők azt vizsgálták, hogy a mesterséges intelligencia képes-e megjósolni a klinikailag jelentős prosztatarákot a következő 30 hónapban a TINT biopsziák morfológiai jelei alapján. A munka egy korábban bemutatott előzetes tanulmány vonalára épít, és alkalmazott alapot képez a „terepi” digitális biomarkerek bevezetéséhez a betegútvonal-tervezésben egy kezdeti „tiszta” biopszia után.
Hogyan készült: tervezés, adatok, algoritmus
A szerzők retrospektíven gyűjtöttek össze 232 férfiból álló kohorsz adatait, akiknél emelkedett a PSA-szint, és a tűbiopszia kezdeti következtetése „jóindulatú” volt (a technikai kontroll után 213 beteget és 587 metszetet vontak be a végső elemzésbe; biopsziák 1997-2016, Umeå, Svédország). Minden beteget egy „tükör” párral illesztettek életkor, a diagnózis éve és a PSA-szint alapján: a felüknél később (≤30 hónap) diagnosztizáltak prosztatarákot, a másik felük legalább 8 évig rákmentes maradt. A H&E metszeteket digitalizálták (20×), 256×256 pixeles csempékre vágták, és CLAM-ba (Clustering-constrained Attention Multiple-Instance Learning) táplálták - egy modern, gyengén felügyelt rendszerbe, ahol csak a beteg sorsa ismert, az egyes pixelek jelölése nem. A jellemzőket a ResNet18 programmal 57 hisztopatológiai adathalmazon előképezve vizsgálták. A végpont bináris: alacsony kockázatú (jóindulatú/ISUP1) vs. magas kockázatú (ISUP2-5).
Előrejelzés pontossága
Egy független tesztben a modell 0,81-es AUC értéket ért el a metszeteken, és 0,82-es AUC értéket a betegek szintjén. Egy elfogadható egyensúlyt biztosító küszöbértéken az érzékenység 0,92 volt, a téves pozitív arány pedig 0,32 (betegszinten). Más szóval, azok között, akiknek a kezdeti biopsziája „nem sikerült”, a mesterséges intelligencia helyesen jelölte meg azoknak a túlnyomó többségét, akiknél hamarosan klinikailag jelentős rákot igazoltak, bár néhány téves riasztás árán. A klinika számára ez egy jelzés: „jóindulatú” biopsziás válasz ≠ nulla kockázat, és digitális üveggel kvantitatívan rétegezhető.
Pontosan mit „észlel” a mesterséges intelligencia a „normális” szövetben?
Az UMAP és a figyelemtérképek segítségével végzett értelmezés azt mutatta, hogy a stromális változások a leginformatívabbak:
- Több kollagén a sztrómában (mátrixtömörödés, „fibrózis”);
- Kevesebb simaizomsejt a mirigyek körül;
- Kevésbé gyakoriak a finom jelek a mirigyhámban, valószínűleg az elérhető lefelé irányuló mintavételezési felbontás alatt.
Ez a minta illeszkedik a TINT (tumor-instructed/indicating normal tissue, azaz tumor által vezérelt/normál szövetet jelző) koncepcióba: még a rejtett tumorú szervben lévő „normális” állapot is átalakul a tumor hatása alatt, és eltér a tumor nélküli szerv „normális állapotától”. A rák nemcsak egy góc, hanem egy mező is, és a mesterséges intelligencia megtanulja olvasni a mezőhatást.
A megközelítés gyakorlati hasznossága – lehetséges forgatókönyvek
- Kockázatalapú rebiopszia: magas mesterséges intelligencia arány "tiszta" üvegen - érv a korai rebiopszia vagy az MRI-irányítás mellett a várakozás helyett.
- A monitorozás személyre szabása: Az alacsony sebesség ellensúlyozza a „határeset” MRI utáni szorongást, és lehetővé teszi a monitorozás intenzitásának mérséklését.
- TINT minta betanítása: A figyelemtérképek és az interaktív rétegek segítenek a patológusoknak a rák körüli finom mezők felismerésében, javítva a jelentések következetességét.
Fontos megérteni a korlátokat
Ez egyetlen központ Észak-Svédországban (túlnyomórészt kaukázusi lakosság), a vizsgálat felépítése retrospektív, az alap biopsziákat MRI-vezérlés nélkül végezték (szisztematikus TRUS-biopsziák), és a markerek jövőbeli kimeneteleket jelölnek, nem pedig „ugyanazon a tárgylemezen lévő okkult tumort”. Független központokban/szkennerekben még nincs külső validáció, és az algoritmus klinikai döntésekre és eredményekre gyakorolt hatását sem vizsgálták prospektíven. A téves pozitív arány továbbra is jelentős – a modell nem helyettesíti az orvost, de valószínűségi réteget ad a megosztott döntéshozatalhoz.
Mi a következő lépés: Megvalósítási ütemterv
- Többközpontú külső validáció (különböző szkennerek, protokollok, etnikai csoportok).
- Prospektív döntési vizsgálatok: az AI-pontszám befolyásolja-e a betegek kórlefolyását (a diagnózisig eltelt idő, a szükségtelenül ismételt biopsziák száma, túl-/aluldiagnózis).
- MRI-vel és klinikai vizsgálatokkal való integráció: kombinált modellek (PSA, MRI PIRADS, klinikai tényezők + TINT pontszám a H&E szerint).
- Technikai lépések: a digitalizáció szabványosítása, az adateltolódás szabályozása, magyarázhatóság (a rutinhoz kapcsolódó figyelemfelkeltések).
Forrás: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C. és mások. Jóindulatú prosztata biopsziákban morfológiai változásokra utaló tumor felfedezése mesterséges intelligencia segítségével. Tudományos jelentések (Nature Portfolio), közzétéve 2025. augusztus 21-én. DOI: https://doi.org/10.1038/s41598-025-15105-6
