
Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Hipofízis vérszegénység (törpeség)
A cikk orvosi szakértője
Utolsó ellenőrzés: 12.07.2025
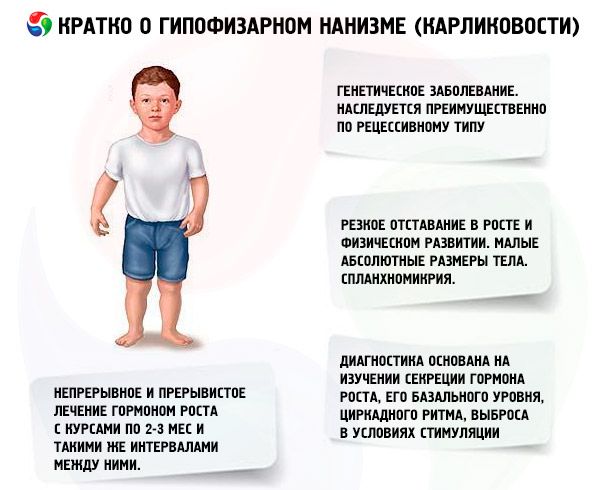
Az „agyalapi mirigy törpesége” kifejezés (a görög nanos – törpe szóból; szin.: törpeség, nanoszómia, mikroszómia) abszolút értelemben olyan betegséget jelent, amelynek fő megnyilvánulása a növekedés éles visszamaradása, amely az elülső agyalapi mirigy növekedési hormonjának szekréciójának zavarával jár.
Tágabb értelemben a törpeség a növekedés és a fizikai fejlődés rendellenessége, amelynek előfordulását nemcsak a szomatotrop hormon abszolút vagy relatív hiánya okozhatja, amely maga az agyalapi mirigy patológiájából ered, hanem a hipotalamusz (agy) funkcióinak szabályozásának zavara, a szomatotrop hormon bioszintézisének hibái és a szövetek hormonnal szembeni érzékenységének zavarai is.
Okoz törpeség
Az agyalapi mirigy törpeségének legtöbb formája genetikai betegség. A leggyakoribb a panhypopituitáris törpeség, amely főként recesszív módon öröklődik. Feltételezik, hogy ennek a patológiás formának kétféle átviteli módja van: autoszomális és X-kromoszómán keresztül. Ebben a törpeségben a szomatotrop hormon szekréciójának zavarával együtt leggyakrabban a gonadotropinok és a pajzsmirigy-stimuláló hormon szekréciója zavart szenved. Az ACTH szekréciója ritkábban és kisebb mértékben zavart szenved. A felszabadító hormonokkal, köztük a szintetikus szomatotropin-felszabadító hormonnal (29, 40 és 44 aminosavmaradékból áll), a hasnyálmirigy-polipeptidhez hasonlóan, végzett funkcionális vizsgálatok kimutatták, hogy ezeknél a betegeknél a legtöbb esetben a hipotalamusz szintjén alakul ki patológia, és az agyalapi mirigy elülső lebenyének elégtelensége másodlagos. Maga az agyalapi mirigy primer patológiája ritkábban fordul elő.
Oroszországban és a szomszédos országokban szórványosan fordul elő genetikai törpeség izolált növekedési hormonhiány mellett, károsodott biológiai aktivitással és érzékenységgel. Gyakoribb az amerikai kontinensen, a Közel-Kelet és Afrikában. A szomatotrop hormon vértartalmának és a betegek exogén szomatotrop hormonnal szembeni érzékenységének, az immunreaktív inzulin (IRI), az I. típusú (szomatomedin C) és II. típusú inzulinszerű növekedési faktorok (IGF) szintjének, valamint az IGF-1 szomatotrop hormonkészítményekkel való kezelésre adott válaszának vizsgálata alapján a klinikailag hasonló törpeség különböző változatait azonosították.
Nemrégiben megfejtették a Laron-törpeség patogenezisét, amelyet az IRF-1 és IRF-II hiánya okoz, valamint az afrikai törpefélék törpeségének patogenezisét, amely az előbbi hiányával jár.
1984-ben leírták a pszeudo-hipofízis törpeség egy új változatát, amely magas szomatotrop hormon és IGF-1 szinttel jár; a törpeség kialakulását a receptorok hibája magyarázza, amit a bőrfibroblasztok IGF-1-hez való kötődésének hirtelen csökkenése bizonyít.
Hangsúlyozni kell, hogy modern körülmények között, kis családok jelenlétében, a betegség számos izolált („idiopátiás”, sporadikus) esete genetikai eredetű is lehet.
350 kórtörténet elemzése során 228 betegnél (65,2%) nem volt tisztázott a törpeség etiológiája. Ebbe a csoportba 57 olyan család betegei tartoztak, ahol a törpeség ismételten előfordult (családonként 2-4 eset), ami az összes beteg 28%-át tette ki. Az etiológiailag nem tisztázott (többnyire genetikai) törpeség formájú családok 77%-ában tagadhatatlan összefüggést állapítottak meg az Rh-faktor hiányának öröklődésével. A törpeségben szenvedő betegek családjaiban az Rh-faktor eloszlása eltér az anya és a magzat közötti Rh-konfliktusban megfigyelttől, és általában nem jár együtt az újszülött hemolitikus betegségével (az apa lehet Rh-negatív, a szülők Rh-faktorra való heterozigótája esetén pedig a gyermekek stb.). Feltételezhető az összefüggés a szomatotrop hormon (vagy szomatotropin-felszabadító hormon) szintéziséért felelős gének aktivitása és az Rh-faktort meghatározó gének között, különösen mivel a törpeség legtöbb formája és az Rh-faktor hiánya autoszomális recesszív tulajdonság. Ez nem magyarázza a törpeség relatív ritkaságát az Rh-negatív egyének populációbeli gyakoriságához képest. Valószínűleg néhány eddig ismeretlen további tényező is fontos, de az Rh-faktor eloszlásának jellemzői a familiáris és sporadikus törpeségben szenvedő betegek családjaiban valószínűleg nem véletlenszerűek.
A törpeségben (primer agyi, agy-hipofízis) szenvedő betegek nagy csoportját azok a betegek alkotják, akik a központi idegrendszer különféle organikus patológiáiban szenvednek, amelyek méhen belül vagy kora gyermekkorban alakultak ki. Az anatómiai szubsztrát, amely ezt a patológiát kiváltja, lehet az agyalapi mirigy alulfejlettsége vagy hiánya, disztópiája a sella turcica kialakulásának patológiájában, az agyalapi mirigy cisztás degenerációja, daganat okozta kompresszió miatti sorvadása (craniofaryngióma, kromofób adenoma, meningióma, glioma). A törpeség oka lehet a hipotalamusz-hipofízis régió traumás sérülése (méhen belüli, születés utáni vagy szülés utáni), amely gyakran előfordul többes terhességben, valamint farfekvéses, lábfejes vagy haránt helyzetben, lábon rotáló szülés során (ez a szülés mechanizmusa a törpeségben szenvedő betegek több mint 1/3-ánál). Jelentősek a fertőző és toxikus károsodások (méhen belüli vírusfertőzések, tuberkulózis, szifilisz, malária, toxoplazmózis; korai életkori betegségek, újszülöttkori szepszis, meningo- és arachnoencephalitis stb.). Ezek a folyamatok károsíthatják magát az agyalapi mirigyet, a működését szabályozó hipotalamusz központokat, és megzavarhatják a központi idegrendszer normális funkcionális kapcsolatait.
A méhen belüli magzati elváltozások olyan betegek születéséhez vezethetnek, akiknél a növekedési hormon elválasztása normális (agyi primordiális törpeség, mikrokefália, Silver-Russell törpeség testfélaszimmetriával és magas gonadotropinszinttel stb.).
További tényezők, amelyek súlyosbítják a törpeség fizikai fejlődésének zavarát, lehetnek a nem megfelelő táplálkozás, az esszenciális összetevők (fehérjehiány) és mikroelemek (cinkhiány) kiegyensúlyozatlan hiánya, valamint a kedvezőtlen környezeti feltételek, valamint a különböző krónikus betegségek, például a glomerulonephritis, amelyben az azotémia befolyásolja a májreceptorok aktivitását, vagy közvetlenül befolyásolja a májsejtek anyagcseréjét, ami a szomatomedin szintézisének csökkenését vagy a májzsugorodást okozza, amikor a szomatomedin képződése károsodik.
Pathogenezis
A legtöbb agyalapi mirigy törpeségében szenvedő betegnél a változások nem korlátozódnak a szomatotrop hormon szekréciójának patológiájára és az arra való érzékenységre, hanem kiterjednek az agyalapi mirigy más trópusi hormonjaira is, ami az endokrin és anyagcserezavarok különböző kombinációit okozza.
Izolált szomatotrop hormon hiány esetén az agyalapi mirigy morfológiai változásait kevéssé tanulmányozták. A vizsgált esetekben ritkán találtak kóros elváltozásokat (craniofaryngiómát vagy a koponyacsontok hiperosztózisát). Ennél a törpeségtípusnál megfigyelhető a peptiderg sejtek veleszületett fejletlensége vagy a hipotalamusz neurotranszmitter rendszerének hibája. Ilyen esetekben a törpeség kombinálódhat a látóidegek diszpláziájával vagy hipopláziájával. Az intraselláris ciszták, az agyalapi mirigy és a hipotalamusz daganatai az agyalapi mirigy hiányához vezetnek, ami az agyalapi mirigy szövetének, különösen a szomatotrop sejteknek a kompresszióját okozza.
A törpeségre a csontok elvékonyodása jellemző, főként a kéregréteg miatt, a csontváz késleltetett differenciálódása és elcsontosodása. A belső szervek hipoplasztikusak, néha atrófiásak, az izmok pedig gyengén fejlettek.
Tünetek törpeség
Az agyalapi mirigy törpeségének fő megnyilvánulása a növekedés és a fizikai fejlődés meredek elmaradása. A betegek normális testtömeggel és testhosszal születnek, és 2-4 éves koruktól kezdenek lemaradni a növekedésben.
A nanizmus aktív kezelésének megjelenése előtt a törpéket a nőknél 120 cm-nél, a férfiaknál pedig 130 cm-nél kisebb magasságúaknak tekintették. Jelenleg a törpe magassága legalább 2-3 szigma eltéréssel tér el az adott nem, életkor vagy populáció átlagos táblázatos normájától. Létezik egy módszer a magasság grafikus értékelésére is, amely a Gauss-eloszlási görbe alapján történik. Ebben az esetben a magasság szerinti törpéket egy olyan csoportba sorolják, amely a megfelelő populációban a legkisebb számú egyedet tartalmazza, amelyek a legnagyobb elmaradással rendelkeznek az átlagos növekedési normától.
Az agyalapi mirigy törpeségét nemcsak a kis abszolút testméret jellemzi, hanem a kis éves növekedés és fizikai fejlődési dinamika is. A testalkat arányos, de a betegek testének arányai a gyermekkorra jellemzőek. A bőr sápadt, gyakran sárgás árnyalatú, száraz, ami abszolút vagy relatív pajzsmirigy-elégtelenségnek köszönhető, néha cianózis - a bőr "márványosodása" - figyelhető meg. Kezeletlen betegeknél korán megjelenik az öregedésgátló hatású és ráncos bőr (geroderma). Ez az STH anabolikus hatásának elégtelenségének és a sejtgenerációk lassú változásának köszönhető.
A fejen lévő haj lehet normális vagy száraz, vékony, törékeny; jellemzőek a hosszú szempillák. A másodlagos szőrnövekedés gyakran hiányzik. A sella turcica mérete a törpeségben szenvedő betegek többségénél (70-75%) nem változik, de a sella gyakran megtartja gyermeki "álló ovális" alakját, széles "juvenilis" háttal rendelkezik, az ékcsont sinusa elmarad a pneumatizáció tekintetében. Vannak azonban olyan betegek, akiknél a sella turcica megnagyobbodott, ami daganat jele; meszesedési területek találhatók a hátterében vagy a bejárat területén (craniofaryngióma, neuroinfekció maradványhatásai esetén) vagy csökkenésében (fejletlenség jelei, az agyalapi mirigy kis mérete). Az intrakraniális hipertónia tünetei figyelhetők meg: a koponyaboltozat csontjainak elvékonyodása, fokozott érhálózat, ujjlenyomatok jelenléte stb. Az agyalapi mirigy törpeségének legfontosabb jele a csontváz differenciálódásának és elcsontosodásának időzítésének késése. A fogászati rendszer jellemzői is szorosan összefüggenek a csontváz differenciálódásával: a tejfogak késői cseréje megfigyelhető. A csontrendszer fejlődésében a legnagyobb késést a szexuális elégtelenséggel és pajzsmirigy-alulműködéssel küzdő törpe betegeknél figyelték meg.
A legtöbb beteg nemi szerve súlyosan fejletlen, bár a rendellenességek ritkák. A férfi betegek 5,8%-ánál figyeltünk meg kriptorchidizmust. A szexuális elégtelenséget a másodlagos szexuális jellemzők fejletlensége és a csökkent szexuális vágy, a menstruáció hiánya kíséri. Normális spontán szexuális fejlődés csak izolált növekedési hormon-hiányban szenvedő betegeknél és egyes agyi törpeségben szenvedő betegeknél figyelhető meg.
A pajzsmirigy-elégtelenség a törpeség meglehetősen gyakori tünete. Meg kell jegyezni, hogy a hipotireózis külső megnyilvánulásai nem mindig tükrözik a pajzsmirigy valódi funkcionális állapotát. Ez a relatív hipotireózisnak köszönhető, amely a tiroxin (T4 ) trijód-tironinná (T3 ) történő átmenetének zavara és az inaktív (reverzibilis)T3 képződése miatt következik be, ami a szomatotropikus elégtelenségre jellemző.
Az agyalapi mirigy törpeségében az adrenokortikotrop funkció ritkábban és kisebb mértékben csökken, mint a nemi és pajzsmirigy-stimuláló funkciók, és a legtöbb betegnél nem igényel speciális korrekciót.
A legtöbb esetben az intellektus nem károsodott. Érzelmi változások mentális infantilizmus formájában jelentkeznek; idősebb, értelmi károsodás nélküli betegeknél néha reaktív neurózisok is megfigyelhetők.
Szerves agyi patológiában, különösen daganatos jellegűben, a törpeség előfordulhat a cukorbetegség insipidus, a bitemporális hemianopsia és az értelmi fogyatékosság tüneteivel.
A központi idegrendszer szerves tünetei nélküli betegek agyi bioelektromos aktivitásának fejlődésének vizsgálata kimutatta, hogy EEG-jükre az éretlenség, a magas "gyermeki" EEG-feszültség hosszú távú megőrzése jellemző; az alfa-ritmus amplitúdójának és frekvenciájának egyenetlensége; a lassú θ- és δ-ritmusok tartalmának hirtelen növekedése, különösen a frontális és a központi elvezetésekben; a hiperventilációra adott egyértelmű reakció; az EEG-ritmusok tartományának eltolódása a fényingerlés ritmusát követően az alacsony frekvenciák felé (az agy idegszerkezeteinek funkcionális mobilitásának csökkenésére utaló bizonyíték). Kiderült, hogy idősebb betegeknél az agy elektromos aktivitásának éretlen jellege a szexuális alulfejlettségnek, minden korosztályú betegnél pedig a pajzsmirigy-alulműködésnek köszönhető.
A törpeségben szenvedő betegek szénhidrát-anyagcseréjét az éhomi vércukorszint csökkenésének hajlama, fizikai megterhelés során történő emelkedése, az endogén inzulin elégtelensége, az exogén inzulinnal szembeni fokozott érzékenység és a hipoglikémiás állapotok gyakori kialakulása jellemzi. Ez utóbbit főként a betegek szervezetében lévő antiinzuláris hormonok elégtelen szintje magyarázza.
A belső szervek splanchnomycria, azaz méretük csökkenése figyelhető meg. A törpeségre jellemző belső szervek funkcionális változásait nem írták le. Gyakran megfigyelhető az artériás hipotenzió csökkent szisztolés és diasztolés nyomással, valamint csökkent pulzusamplitúdóval. A szívhangok tompák, a szívizom trofikus változásai és az autonóm zavarok miatt különböző témájú funkcionális zörejek hallhatók. Az EKG-ra alacsony volta (különösen pajzsmirigy-alulműködés esetén), sinus bradycardia vagy bradyarrhythmia jellemző; a PCG a hangok amplitúdójának csökkenését, további hangokat és funkcionális zörejeket mutat. Az oxigemometriás adatok hipoxémiát (kezdetben és fizikai terhelés alatt) és oxigénadósságot mutatnak. Idős betegeknél néha magas vérnyomás alakul ki.
Diagnostics törpeség
A törpeség diagnózisa és differenciáldiagnózisa az anamnézis adatain és átfogó klinikai, radiológiai, laboratóriumi és hormonális vizsgálaton alapul. Az abszolút testméret mellett a betegek növekedésének felméréséhez meghatározzák a növekedési deficitet - a beteg magassága és a megfelelő nemre és életkorra vonatkozó átlagos normája közötti különbséget; a növekedési kort - a beteg magasságának bizonyos szabványoknak való megfelelését; a normalizált eltérés mutatóját.
I = M - Mcp / δ, ahol M a beteg magassága, Mcp az adott nemhez és életkorhoz tartozó átlagos normál magasság, δ a Mcp-től való négyzetes eltérés; az I < 3 a nanizmusra, az I > 3 a gigantizmusra jellemző. Ez a mutató a fejlődés dinamikájának felmérésére használható.
A törpeségben szenvedő betegek röntgenvizsgálata intrakraniális hipertónia, neuroinfekció maradványhatásai, meszesedések és kranioszinosztózis jeleit mutatja. A török üreg (sella turcica) méretének, alakjának és szerkezetének vizsgálata az agyalapi mirigy méretét jellemző közvetett mutatónak tekinthető. A kóros növekedési retardáció egyik legfontosabb megnyilvánulása a csontváz differenciálódásának zavara. A csontváz érettségének mértékének felméréséhez meghatározzák a csont (radiográfiai) korát, amely megfelel a csontszövet differenciálódásának; a csontosodási hiány a normától való elmaradás mértéke (években), a csontosodási együttható a csontosodási kor kronológiai és egyéb paraméterekkel való osztásának hányadosa.
A törpeség modern diagnosztikája lehetetlen a szomatotrop hormon szekréciójának, alapszintjének, cirkadián ritmusának és stimulációra történő felszabadulásának vizsgálata nélkül. A hipofízis törpeségben szenvedő betegek többségére a szomatotrop hormon csökkent szérumszintje jellemző. Radioimmunológiai módszerrel meghatározva (különböző szerzők szerint) (0,87±0,09) és (1,50±0,64) ng/ml között van, átlagosan (3,81±0,29) ng/ml-rel. A szomatotrop hormon szekréciójának napi (cirkadián) ritmusának vizsgálata kimutatta, hogy egészséges emberekben a szintje az alvás első 2 órájában és reggel 4-6 óra között a legmagasabb. Törpeség esetén a szomatotrop hormon tartalma ezekben az órákban is csökken.
A szomatotrop funkció tartalékainak vizsgálatára különféle stimulánsokat alkalmaznak, a szomatotrop hormon tartalmát a beadásuk előtt és után vizsgálják. A vizsgálathoz 2-3 órán keresztül 30 percenként vért vesznek. A stimuláció utáni szomatotrop hormon felszabadulását legalább 7-10 ng/ml-ig normálisnak tekintik, néha eléri a 20-40 ng/ml-t. Ha az egyik mintában nincs reakció, ismételt vizsgálatokat végeznek más stimulánsokkal. A szomatotrop hormon elégtelenségét bizonyítottnak tekintik, ha 2-3 különböző mintában nem szabadul fel szomatotrop hormon.
A leggyakrabban használt stimulációs tesztek a következők: 0,1 E (0,75-1,5 E) inzulin intravénás beadásával testtömegkilogrammonként és hipoglikémia (a vércukorszint 50%-os csökkenése a kezdeti szinthez képest) elérésekor a szérum szomatotrop hormon szintjét a fenti séma szerint határozzák meg. Súlyos hipoglikémia kialakulása esetén a tesztet megszakítják, és a beteg intravénásan glükózt kap. Ez a leggyakoribb, klasszikus diagnosztikai módszer.
TRH 200-500 mcg dózisban intravénásan. Hatékonyan azonosítja a hormontartalékokat, nem okoz szövődményeket. Az inzulinteszttel kombinálva lehetővé teszi a hipotalamusz-hipofízis rendszer károsodásának mértékének megítélését. A TRH-ra adott pozitív reakció inzulinhipoglikémiára inzulin hiányában az agyalapi mirigy épségét és a hipotalamusz szintjén jelentkező károsodást jelzi, a TRH-ra és a hipoglikémiára adott negatív reakciók pedig magának az agyalapi mirigynek a károsodását jelzik.
A TRH, LH-RH 300 mcg intravénás dózisban hasonló az előzőhöz.
Az emberi SGH egy hasnyálmirigy-daganatból izolált biológiailag aktív vegyület szintetikus analógja. Jelenleg 3 típusú szintetikus SGH létezik: 29, 40 és 44 aminosavmaradékkal. Intravénásan alkalmazzák, a beteg testtömegére vonatkoztatva 1-3 μg/kg dózisban. Az STH felszabadulását 15-20 perccel a beadás után figyelik meg, a teszt hatékonyabb, mint mások az endogén növekedési hormon tartalékainak kimutatásában. A pozitív SGH-reakció a hipotalamusz szomatotrop funkciójának károsodását és az ép agyalapi mirigyet jelzi; aminosavakkal (L-arginin-monoklorid, ornitin, triptofán, glicin, leucin) intravénásan, a beteg testtömegére vonatkoztatva 0,25-0,5 g dózisban. Hatékony az SGH tartalékok vizsgálatára. Allergiás reakciókat okozhat.
L-dopa orálisan, 250-500 mcg dózisban. Hatékony, a betegek jól tolerálják.
Glukagonnal, bróm-ergokriptinnel (parlodel), lizin-vazopresszinnel, klonidinnel és adagolt kerékpár-ergometrikus terheléssel végzett vizsgálatokat is alkalmaznak.
A szomatotrop funkció állapotának vizsgálata nemcsak a törpeség diagnosztizálásához szükséges, hanem a terápiás módszer indokolt megválasztásához is, mivel a szomatotropinnal történő kezelés csak endogén növekedési hormon elégtelenség esetén racionális.
A törpeség formájának diagnosztizálásához nagyon fontos az inzulinszerű növekedési faktorok, vagy szomatomedinek (különösen az IGF-1 vagy szomatomedin C) tartalmának vizsgálata - ezek a szomatotróp hormon hatásának szöveti szintű mediátorai. Ismert, hogy a szomatomedin C tartalma törpeség esetén csökkent, akromegália esetén pedig emelkedett a normálishoz képest. A Laron által leírt törpeség egy olyan betegség, amelyben a szomatotróp hormon normális termelődéssel jár, de az IGF-1 és IGF-II képződésének zavarával. Az ilyen betegek szomatotropinnal történő kezelése hiábavaló.
Az agyalapi mirigy szomatotrop funkciójának közvetett mutatói az alkalikus foszfatáz aktivitása és a szérum szervetlen foszfortartalma. Hiposzomatotrop körülmények között ezek a mutatók csökkennek. A törpeség panhypopituitáris formájában a gonadotropinok, gyakran a TSH szekréciója csökken, amit a nemi mirigyek (androgének vagy ösztrogének hiánya), a pajzsmirigy (a T3 , T4 , a fehérjéhez kötött jód - PBI - szintjének csökkenése, 131I felhalmozódása a pajzsmirigyben) és a mellékvesék (a kortizol és a 17-OCS mennyiségének csökkenése a plazmában, a 17-KC és a 17-OCS kiválasztása a vizelettel, limfocitózis) funkcióinak megfelelő csökkenése kísér.
Az agyalapi mirigy (hipotalamusz-hipofízis) genetikai törpeség minden típusára jellemző a gyermekek ismételt betegsége egy családban, autoszomális recesszív (gyakrabban) vagy autoszomális domináns típusú öröklődéssel, növekedési retardáció és fizikai fejlődés 2-4 éves kortól, legalább 2-3°-os elmaradással az adott nem, életkor, populáció átlagos növekedési normáitól, alacsony spontán éves növekedési dinamikával, késleltetett csontosodással. Alacsony szomatotrop hormonszint esetén (2-3 stimulációs tesztben 7 ng/ml alatt) a szomatotrop hormonnal végzett terápia rendkívül hatékony (évente legalább 7 cm-es növekedést eredményez). Normális vagy magas szomatotrop hormonszint esetén (biológiai inaktivitásával) a hormonnal szembeni érzékenység megőrizhető. Az intelligencia változása nem figyelhető meg.
A szomatotrop hormonnal szembeni szöveti érzéketlenséggel járó genetikai törpeség esetén a klinikai kép hasonló az izolált növekedési hormon hiányához, de a szomatotropin terápia hatástalan. Ebben a csoportban az IRF szintje szerint a következő fő formák különböztethetők meg: normál tartalommal (IRF receptor defektus) és csökkent - Laron típusú törpeség (IRF-1 és IRF-II hiány) és az afrikai törpéknél található típus (IRF-1 hiány).
Az agyi törpeséget a központi idegrendszer intrauterin vagy postnatális károsodásával összefüggő, elszigetelt családi betegségek jellemzik, a központi idegrendszerben nyilvánvaló szerves változások jelenlétével, gyakran a vizuális szerv patológiájával, a diabetes insipidus jelenlétével, a gonadotrop funkciók megőrzésével és az intelligencia változásaival kombinálva.
Bizonyos típusú gonád diszgenezis és agenézisek, különösen a Shereshevsky-Turner szindróma és a here diszgenezis szindróma "Turneroid" (mozaikos) formája, jelentős alacsony termettel járnak. A citogenetikai vizsgálatok (ivarkromatin, kariotípus) segítenek a differenciáldiagnózisban, feltárva a kromoszóma-rendellenességeket, valamint a szomatikus és szexuális fejlődés jellegzetes rendellenességeit, az endogén szomatotrop hormon normális vagy emelkedett szintjét, valamint a szomatotropinnal szembeni érzéketlenséget.
Az alacsony termetűséggel járó endokrin rendellenességek közül ki kell emelni az elsődleges pajzsmirigy-alulműködést, amelyet a pajzsmirigy veleszületett hipoplaziája vagy apláziája, disztópiája, a pajzsmirigyhormonok bioszintézisének enzimatikus hibái, valamint a pajzsmirigy korai autoimmun károsodása okoz. Mindezen állapotokban a pajzsmirigy-alulműködés jelei dominálnak, magas TSH-szinttel, a T4 és T3 szintjének csökkenésével a vérszérumban . Autoimmun eredetűmyxödéma esetén a vérben tireoglobulin, a pajzsmirigyszövet mikroszomális és nukleáris frakciói elleni antitestek mutathatók ki, a szomatotrop hormon szintje normális vagy csökkent. A klinikai hatás csak a pajzsmirigy-alulműködés kompenzálásával érhető el.
Az alacsony termetet korai szexuális fejlődés és adrenogenitális szindróma kíséri a növekedési zónák korai lezáródása miatt; Itsenko-Cushing-kór, amely gyermekkorban jelentkezik a glükokortikoidok szomatotrop hormon szekréciójára gyakorolt gátló hatása és katabolikus hatásuk miatt; Mauriac-szindróma - súlyos inzulinfüggő cukorbetegségben szenvedő betegek alacsony termete és infantilizmusa.
Az agyalapi mirigy törpeségét meg kell különböztetni a krónikus anyagcserezavarok (máj-, vese-, gyomor-bélrendszeri betegségek), krónikus hipoxia (szív- és érrendszeri, valamint légzőrendszeri betegségek, vérszegénység) által okozott szomatogén fizikai fejlődési késéstől; a mozgásszervi rendszer szisztémás betegségeivel (kondrodystrophia, osteogenesis imperfektum, exostosis betegség) stb.
A funkcionális (alkotmányos) növekedési retardáció néha megfigyelhető a pubertás késői kezdetével látszólag egészséges serdülőknél; azt találtuk, hogy ez elsősorban a gonadotrop aktivitás átmeneti elégtelenségével jár. A szomatotrop hormon szekréciója általában nem károsodik, vagy enyhén csökken. A gonadotropinok stimulációja felgyorsíthatja mind a szexuális fejlődést, mind a növekedést.
A családi jellegű alacsony termetet a fiziológiai fejlődés egyik változatának kell tekinteni.
Mit kell vizsgálni?
Hogyan kell megvizsgálni?
Milyen tesztekre van szükség?
Ki kapcsolódni?
Kezelés törpeség
A törpeség kezelése hosszú folyamat. Ez arra kényszeríti az orvost, hogy a növekedés befolyásolására szolgáló eszközöket időbeli elosztással érje el a legnagyobb klinikai hatás elérése érdekében, két alapelv betartása mellett:
- a kezelés által kiváltott fejlődés maximális közelítése a fiziológiai körülményekhez;
- kímélve az epifízis növekedési zónákat.
A törpeség kezelésében szerzett sokéves tapasztalat lehetővé teszi számunkra, hogy a következő szakaszos terápiás sémát tartsuk megfelelőnek. A törpeség diagnózisa felnőtt betegeknél általában nem vet fel kétségeket. Kisgyermekeknél, ha a klinikai kép nem egyértelmű, diagnosztikai időszakra van szükség: 6-12 hónapos megfigyelés hormonterápia nélkül. Ez idő alatt komplex általános erősítő kezelést írnak elő; megfelelő táplálkozást az állati fehérje, a zöldségek és gyümölcsök tartalmának növelésével az étrendben, A- és D-vitamint, kalcium- és foszforkészítményeket. A növekedés és a fizikai fejlődés megfelelő változásainak hiánya ezen a háttéren, valamint az endokrin rendellenességek kimutatása a vizsgálat során az alapja a hormonterápia megkezdésének.
Az agyalapi mirigy törpeségének fő patogenetikai terápiája az emberi növekedési hormon alkalmazása, mivel a törpeség legtöbb esetének előfordulása kétségtelenül a hiány egyik vagy másik formájától függ. E hormon fajspecificitása miatt csak az emberi és főemlős szomatotropin hatásos az emberre. A klinikumban széles körben alkalmazzák a nem fertőző és nem neoplasztikus betegségekben elhunyt emberek agyalapi mirigyéből izolált gyógyszert. Az emberi szomatotropint bakteriális szintézissel, Escherichia coli felhasználásával, géntechnológiával állítják elő. Az emberi szomatotropint kémiai úton is szintetizálják, de ez rendkívül drága, és gyakorlatilag nem alkalmazzák a klinikumban. A szomatotropin kezelésre azokat a betegeket választják ki, akiknél bizonyítottan hiányzik az endogén növekedési hormon, és akiknek a csontváz differenciálódása nem haladja meg a 13-14 évesekre jellemző szintet. A kezelésre nincsenek korhatárok.
A kezelés első időszakában alkalmazható minimális hatásos dózis 0,03-0,06 mg/testtömegkg. A leghatékonyabb dózis hetente háromszor 2-4 mg. Az egyszeri dózis 10 mg-ra történő emelése nem járt együtt a növekedési hatás megfelelő fokozódásával, de a szomatotropin elleni antitestek gyors képződését okozta.
Hazánkban 1960 óta folyik az emberi növekedési hormon vizsgálata. Két kezelési módot teszteltek: folyamatos és szakaszos, 2-3 hónapos kúrákkal és azonos időközökkel közöttük. A betegek átlagos magasságnövekedése a kezelés első évében 9,52±0,39 cm, a testtömeg-növekedés 4,4±0,14 kg volt. Hosszú távú, folyamatos kezelés esetén az átlagos magasságnövekedés 0,82 cm/hó, a testtömeg-növekedés 0,38 kg/hó volt; szakaszos kezelés esetén 0,75 cm/hó, illetve 0,4 kg/hó. A folyamatos kezelés gyorsabb magasságnövekedést eredményezett, a hatás 1-1,5 év után hirtelen csökkenésével, szakaszos kezelés esetén a hatékonyság 3-4 évig fennmaradt, ami lehetővé teszi számunkra, hogy a kúrás kezelési módot megfelelőbbnek tekintsük. Az IGF-I (szomatomedin C) szintjének meghatározása megbízható mutatója lehet a beteg szomatotropin gyógyszerekkel szembeni érzékenységének. Az IGF-I tartalom növekedése a szomatotrop hormon bevezetése után lehetővé teszi a terápia pozitív hatásának előrejelzését. A szomatotropin kezelés egyik fontos előnye, hogy a csontváz csontosodása nem gyorsul fel a háttérben.
A törpeség kezelésének legfontosabb eszköze az anabolikus szteroidok alkalmazása, amelyek a fehérjeszintézis fokozásával és az endogén szomatotrop hormon szintjének növelésével serkentik a növekedést. A kezelést több évig végzik, egyes gyógyszerek fokozatos helyettesítésével másokkal, a kevésbé aktív vegyületekről az aktívabbakra. Az anabolikus gyógyszerek váltására akkor van szükség, ha a növekedési hatás 2-3 év után csökken, ami a növekedés további fokozódásához vezet. A kezelést kúrákban végzik (a pihenőidőnek a kezelési időszak felének kell lennie). Függőség esetén hosszabb szünetek is indokoltak (akár 4-6 hónapig). Egyszerre csak egy anabolikus szteroidot írnak fel. 2 vagy több gyógyszer kombinálása nem megfelelő, mivel ez nem fokozza azok metabolikus és növekedési hatását. Ez utóbbi elsősorban a betegek életkorától és a vázcsontok differenciálódásának mértékétől függ a kezelés kezdetén. A legjobb hatást 16-18 év alatti betegeknél figyelik meg, akiknél a csontváz elcsontosodása nem haladja meg a 14 évesekre jellemző szintet. A kezelést a diagnózis után azonnal, általában 5-7 éves kortól célszerű megkezdeni. A kezelés előtt kerülni kell a gonadotropinok és nemi hormonok felírását, amelyek a növekedés serkentése mellett egyidejűleg felgyorsítják a csontváz differenciálódását. Az anabolikus szteroidok adagolásának elve a minimálisan hatékony dózisoktól a fokozatosan növekvő dózisokig terjed. A leggyakoribb gyógyszerek ajánlott dózisai: nerobol (metandrosztenol, dianabol) - 0,1-0,15 mg/ttkg naponta szájon át; nerobolil (durabolin) - 1 mg/ttkg havonta intramuszkulárisan, a havi adagot 2-3 részletben, 15, illetve 10 nap elteltével adják be; retabolil (deka-durabolin) - 1 mg/ttkg havonta egyszer intramuszkulárisan. A megadott dózisok túllépése androgenizációhoz vezethet. Fiziológiás dózisokban ezek a vegyületek nem befolyásolják jelentősen a nemi szervek állapotát és a vázcsontok differenciálódását, ami lehetővé teszi, hogy mindkét nembeli betegeknél hosszú ideig alkalmazzák őket. A lányoknak nőgyógyász felügyelete alatt kell állniuk, mivel túladagolás vagy fokozott egyéni érzékenység esetén egyes betegeknél virilizáció jelei jelentkezhetnek, amelyek a kezelés abbahagyása után gyorsan visszafejlődnek. A 17. pozícióban metilezett, etilezetté alakított orális gyógyszerek néha epeúti hatást okozhatnak, ezért májbetegségek esetén előnyben kell részesíteni a parenterális anabolikus vegyületeket, vagy az orális gyógyszereket epehajtó szerekkel kell kombinálni. Nagyon ritkán az anabolikus szteroidokkal végzett kezelés allergiás reakciókat (viszketést, kiütéseket) okozhat. Szövődmények hiányában az anabolikus szteroidokat mindaddig alkalmazzák, amíg a növekedési hatás megfigyelhető (16-18 éves korig, és néha tovább is). A kezelést általános erősítő terápia hátterében végzik.
Ha a betegeknél pajzsmirigy-alulműködés jelei vannak, a pajzsmirigy-gyógyszereket (tiroxint, tireoidint, tirotomint) egyidejűleg, egyénileg kiválasztott dózisokban írják fel.
Fiúk kezelésében a következő lépés a humán koriongonadotropin beadása. Ezt a gyógyszert legkorábban 15-16 éves korban, gyakran még későbbi korban alkalmazzák a Leydig-sejtek stimulálására, ami felgyorsítja mind a szexuális fejlődést, mind a növekedést (a saját androgénjeik anabolikus aktivitása miatt). 1000-1500 NE dózisokat alkalmaznak hetente 1-2 alkalommal intramuszkulárisan, 2 hónapos kúrákban, évente legfeljebb 2-3 alkalommal. Ha a hatás nem teljes, a 16 éves és idősebb fiúk humán koriongonadotropinnal történő kezelését kis dózisú androgénekkel (metiltesztoszteron 5-10 mg/nap dózisban szublingválisan) váltakozva alkalmazzák.
16 év feletti lányoknál a kezelést kis dózisú ösztrogénekkel lehet kezdeni, amelyek a normális szexuális ciklust szimulálják. A kezelést havonta 3 héten át végzik, majd szünetet tartanak. A ciklus 2. fázisában, a 3. héttől kezdve hetente 3-5 alkalommal 1000-1500 NE koriongonadotropint vagy gesztagén hatású gyógyszereket (pregnin, progeszteron) lehet felírni.
A kezelés utolsó szakasza (a növekedési zónák záródása után) a beteg nemének megfelelő nemi hormonok terápiás dózisainak folyamatos adása, a nemi szervek, a másodlagos nemi jellegek teljes körű kifejlődése, a libidó és a szexuális potencia biztosítása érdekében. A kombinált ösztrogén-progesztogén készítmények (non-ovlon, biszekurin, infekundin, rigevidon) a női betegek, a nyújtott hatóanyag-leadású androgénkészítmények (testenát, sustanon-250, omnadren-250) pedig a férfi betegek kezelésére alkalmasak.
Általános erősítő kezelést végeznek (rendszer, fehérje-zöldség étrend, vitaminterápia, biostimulánsok). Cinkkészítmények alkalmazása javasolt, amelyek hatásmechanizmusában a fő szerepet az IGF-1 (inzulinszerű növekedési faktor I) aktivitásának fokozása játssza.
Központi idegrendszeri szerves patológia jelenlétében gyulladáscsökkentő, reszorptív és dehidratációs terápiát alkalmaznak. A célzott szisztematikus terápia biztató hatást fejt ki. A hosszú távú, szakaszos kezelés eredményeként a 175, mindkét nembeli törpeségben szenvedő beteg közül 148-nak (80,4%) sikerült 130 cm feletti, 92-nek (52,5%) 140 cm feletti, 32-nek (18,3%) pedig 150-160 cm-es vagy annál nagyobb magasságot elérnie. Ugyanakkor 37 beteg (21,2%) 30 cm-rel, 107 (61,1%) 31-50 cm-rel, 31 (17,7%) pedig 51-60 cm-rel vagy annál nagyobb magasságot tapasztalt.
Előrejelzés
A prognózis a törpeség formájától függ. A törpeség genetikai típusai esetén az életre szóló prognózis kedvező. Agyalapi mirigy daganat és a központi idegrendszer szerves károsodásának jelenlétében a fő kóros folyamat fejlődésének dinamikája határozza meg. A modern terápiás módszerek jelentősen növelték a betegek fizikai képességeit és munkaképességét, valamint meghosszabbították várható élettartamukat. Az aktív kezelés időszakában a betegeket 2-3 havonta, fenntartó terápiával 6-12 havonta kell orvosnak megvizsgálnia.
A betegek szellemi és fizikai képességeiknek megfelelő foglalkoztatása kiemelkedő fontosságú társadalmi alkalmazkodásuk szempontjából.
Célszerű olyan szakmákat választani, amelyek nem járnak nagy fizikai megterheléssel, de lehetővé teszik az intellektuális képességek, a precíz munkavégzés képességének és a nyelvtudás bemutatását.


 [
[